+38 (063) 595 80 08 - Viber, Telegram, WatsApp
+38 (063)982 79 79
- Заронтин (этосуксимид) 250мг/5мл сироп 200мл №1 / противосудорожный (суксилеп)
- Саб симплекс суспензия 69.19мг/мл 30мл
- Абилифай 5 мг тб №28
- Алкеран [тб 2мг] №25
- Алкеран табл. п/о 2мг N25
- Эутирал (Аналог тиреотома,Новотирала) тб.100+20мкг №50
- Абилифай 15 мг тб №28
- Абилифай 10 мг тб №28
- Эндотелон тб.150 мг №60
- Цитофлавин р-р для в/в введ.амп.10мл №10***
- Фуцидин крем 2% 15г***
- Гепатромбин Г свечи № 10***
- Немозол таб п/о 400мг №1***
- Дилтиазем [тб 60мг]№30***
- Грандаксин [тб 50мг] №20***
- Резолор таб п/о 1мг №28***
- Дилтиазем Ланнахер тб 180мг30***
- Резолор таб п/о 2мг №28***
- Расилез табл. 150мг №28
- Колхицин табл. 1мг №60
- Эссавен гель 1%+0,8% гель 80г №1
- Ремерон табл. 30мг №30
- Семакс [капли назальные 0.1% 3мл]
- Салвисар мазь 25г
- Фликсоназе спрей наз 50мкг/доза 120доз
- Ацидин-пепсин 250мг табл. №50
- Зипрекса Зидис [тб 10мг] №28
- Кортексин лиоф для инъекций 10мг фл №10
- Кортексин лиоф для инъекций 5мг фл №10
- Акатинол Мемантин 10мг табл. №30
- Элтацин [тб подъязычные] №30
- Натальсид [свечи 250мг] №10
- Анальгин-хинин [тб] №20
- Зиртек таб п/о 10мг №7
- Циндол /цинка оксид сусп 125мл
- Фулфлекс крем 75мл д/тела
- Лоцерил лак 5% 2,5мл фл. №1
- Гепатромбин Г мазь 20г
- Седалит таб 300мг №50
- Эринит таб 10мг №50
- Трилептал табл. 150мг №50
- Грандаксин таблетки 50мг №60
- Лонгидаза супп ваг/рект 3тыс МЕ №10 АКЦІЯ
- Баралгин М [тб 500мг]№20
- Капотен таб 25мг №28
- Утрожестан капс 200мг №14
- Метиндол таб ретард 75мг №25
- Мексидол таб покр пл/о 125мг №30
- Гемаза амп №5
- Лонгидаза порошок 3000МЕ № 5 фл
- Ируксол мазь 30г №1
- Трихлоруксусная кислота 50% р-р 10мл №1
- Синтром (синкумар) 4 мг тб №20
- Модуретик тб 5мг/50мг №20
- Юракс (Кротамитон) крем 20г №1
- Прайтор 40мг табл. №28
- Синемет(Карбидопа и леводопа) таб. 25мг +250мг №50
- Эссавен гель 1%+0,8% гель 80г №1
- Тиклид табл. 250мг №30
- Азатиоприн (Имуран) табл. 50мг №100
- Фризиум 10мг капс №30
- Дифметре табл 20 шт
- Трилептал суспензия 60мг/мл 100мл
- Ливиал таб. 2.5мг N28
- Ренагель 800 мг тб №180
- Блеоцел (Блеомицин) 15мг №1
- Прокарбазин капс. 50 мг №50
- Триампур композитум таб.№50
- Циклоферон р-р для в/в и в/м введ.125 мг/мл 2мл №5***
- Бильтрицид таблетки 600мг №6
- Анафранил таб.п.о.25мг №30
- Мирвасо Дерм гель д/наружн.прим.0,5% туба 30г***
- Альфаган капли глазн.0,2% 2мг/мл фл.-кап.5мл
- Тербинафин спрей 1% 20г №1***
- Цитофлавин р-р для в/в введ.амп.10мл №5
- Логимакс таблетки 50мг+5мг №30
- Гальвусмет таблетки, п/плен. обол. по 50 мг/1000 мг №30
- Фосфоглив УРСО капсулы 35мг+250мг №50
- Преднизолон-рихтер таб.5мг №100
- Акинетон таб.2мг №100
- Ко-Ренитек таб.20мг+12,5мг №28
- Тримедат пор. д/сусп. внутр. 152,5г №1
- Софрадекс капли глазные и ушные 5мл №1
- Гидреа капс.500мг №100
- Адвантан (метилпреднизолон) мазь д/наружн.прим.0,1% 50г
- Прилиджи табл. 30мг №6 лечение преждевременной эякуляции
- Иберогаст капли 20мл***
- Псотриол (ксамиол) гель 30 гр №1
- Безорнил мазь 10мл №1
- Бонвива 150 мг №1
- Витарос 300 (алпростадил) крем по 100 мг №4 от импотенции
- Иксел (милнаципран) 50мг капс №56
- Галавит супп.рект.по 100мг N10
- Овитрел р-ра д/ин.250мкг/0.5мл N1 шприц
- Прилиджи табл. 60мг №6
- Цитофлавин таб.п.о.кишечнораств.№20***
- Уралит-У гран.д/приг.р-ра д/приема внутрь конт.99,8г фл 100 гр
- Вобэнзим иммун №40
- Нео Холензим капс.№20
- Финалгон мазь наружн. туба 20г
- Уротол (Толтеродин) таблетки 2мг №28
- Бонвива 150 мг №3***
- Цистон, Cystone таб. №100***
- Синемет(Карбидопа и леводопа) таб. 25мг +100мг №30
- Весаноид (Третиноин) 10мг №100***
- Уротол (Толтеродин) таблетки 2мг №28
- Митомицин (Mitomycin) 20 мг №1
- Прилиджи табл. 30мг №3***
- Акинетон табл. 2мг №50***
- Бускопан суппоз 10мг №6 в блис
- Галвус Мет(Гальвусмет) [тб 50мг+1000мг] №60
- Нефлуан гель 10г №1
- Телфаст 120 тб мг №10
- Буденофальк капс.тв.с киш./раств.гран.по 3мг N100
- Вобэнзим №200***
- Вобэнзим №100***
- Вольтарен (Вольтадол) пластырь 24 ч трансд.140 мг №5
- Нейротропин-Мексибел 5% 2мл амп №10
- Милдронат цена
- Флуконазол цена
- Цефтриаксон цена
- Пимафуцин цена
- Актовегин цена
- Гексикон цена
- Утрожестан цена
- Актовегин цена в аптеках
- Канефрон в аптеках Киева
- Дуфастон цена в аптеках
Скафо пор д/р-ну д/ін 150мг фл карт кор
- Код товара: 234439
- Производитель: Новартіс Фарма Гмбх, Німеччина
- Действующее вещество: секукинумаб
- Срок годности: до 01.03.26
- Наличие: есть в наличии
Фармакологічні властивості
Фармакодинаміка.
Механізм дії
Секукінумаб являє собою повністю людське моноклональне антитіло IgG1/κ, що селективно зв’язується та нейтралізує прозапальний цитокін – інтерлейкін?17A (IL?17A). Секукінумаб чинить спрямовану дію на IL?17A та інгібує його взаємодію з рецептором IL?17, який експресується різними типами клітин, включаючи кератиноцити. В результаті цього секукінумаб уповільнює вивільнення прозапальних цитокінів, хемокінів і медіаторів пошкодження тканин, знижує внесок ІЛ-17A в аутоімунні і запальні захворювання. Секукінумаб в клінічно значущих концентраціях проникає в шкіру і знижує концентрацію запальних маркерів. Прямим наслідком лікування секукінумабом є зменшення вираженості почервоніння, ущільнення і лущення шкіри, що спостерігається в осередках ураження при бляшковому псоріазі.
IL?17A є природним цитокіном, який бере участь в природних реакціях запалення і імунної відповіді. IL?17A відіграє ключову роль в патогенезі бляшкового псоріазу, псоріатичного артриту та аксіального спондилоартриту (анкілозуючого спондиліту і нерентгенологічного аксіального спондилоартриту) та регулюється в ураженій шкірі на відміну від такого в неураженій шкірі пацієнтів з бляшковим псоріазом, а також в синовіальній тканині пацієнтів із псоріатичним артритом. У пацієнтів з анкілозуючим спондилітом значне збільшення кількості клітин, що продукують IL-17A, відмічається в субхондральному кістковому мозку фасеткових суглобів. Також в крові у пацієнтів з нерентгенологічним аксіальним спондилоартритом виявлено збільшення концентрації IL-17А. Виявлено, що пригнічення IL-17A є ефективним при лікуванні анкілозуючого спондиліту, таким чином, встановлено ключову роль цього цитокіну в аксіальному спондилоартриті.
Фармакодинамічні ефекти
Сироваткові рівні загального IL-17A (вільного і зв’язаного з секукінумабом IL-17A) спочатку збільшувалися у пацієнтів, які отримували секукінумаб. Це відбувалося внаслідок зниження кліренсу пов’язаного з секукінумабом IL-17A, що вказує на те, що секукінумаб селективно зв’язується з вільним IL-17A, відіграючи ключову роль у патогенезі бляшкового псоріазу.
Під час дослідження у пацієнтів з бляшковим псоріазом після одного-двох тижнів лікування секукінумабом значно знижувалися інфільтрація епідермісу нейтрофілами і кількість різних асоційованих з ними маркерів, що часто підвищені в уражених ділянках шкіри у таких пацієнтів.
Показано, що секукінумаб знижує (протягом 1–2 тижнів лікування) рівні C-реактивного білка, який є маркером запалення.
Клінічна ефективність та безпека
Бляшковий псоріаз у дорослих
Безпеку та ефективність застосування секукінумабу оцінювали під час чотирьох рандомізованих, подвійно сліпих, плацебо-контрольованих досліджень III фази у пацієнтів з помірним або тяжким бляшковим псоріазом, яким показана фототерапія або системна терапія (ERASURE, FIXTURE, FEATURE, JUNCTURE).
Ефективність і безпеку застосування секукінумабу в дозі 150 мг та 300 мг оцінювали порівняно з плацебо або етанерцептом. Крім того, в одному дослідженні оцінювався режим тривалої терапії порівняно із застосуванням у разі потреби (SCULPTURE).
З 2403 пацієнтів, включених у плацебо-контрольовані дослідження, 79 % не отримували біологічних лікарських засобів, 45 % не відповіли на терапію небіологічними препаратами, а 8 % не відповіли на терапію біологічними препаратами (6 % не відповіли на терапію анти-ФНП і 2 % не відповіли на терапію анти-р40). Під час досліджень III фази приблизно у 15–25 % пацієнтів відмічений псоріатичний артрит (ПА) на початку дослідження.
В дослідженні 1 псоріазу (ERASURE) оцінювали 738 пацієнтів. Пацієнти, які були рандомізовані до групи секукінумабу, отримували дози 150 мг або 300 мг на 0, 1, 2 і 3 тижні з наступним щомісячним введенням аналогічної дози, починаючи з 4-го тижня. В дослідженні 2 псоріазу (FIXTURE) оцінювали 1 306 пацієнтів. Пацієнти, які були рандомізовані до групи секукінумабу, отримували дози 150 мг або 300 мг на 0, 1, 2 і 3 тижні з наступним щомісячним введенням аналогічної дози, починаючи з 4-го тижня. Пацієнти, рандомізовані до групи етанерцепту, отримували дозу 50 мг двічі на тиждень протягом 12 тижнів, потім 50 мг щотижня. В обох дослідженнях (1 і 2) пацієнти, які були рандомізовані до групи плацебо і які не відповіли на лікування до 12-го тижня, перейшли на секукінумаб (150 мг або 300 мг) на 12, 13, 14 і 15 тижні з наступним щомісячним введенням аналогічної дози, починаючи з 16-го тижня. Всі пацієнти проходили подальше спостереження до 52 тижнів після початку лікування.
В дослідженні псоріазу 3 (FEATURE) оцінювали 177 пацієнтів, які застосовували секукінумаб у попередньо наповненому шприці порівняно з плацебо через 12 тижнів після початку лікування для оцінки безпеки, переносимості та користі самостійного застосування секукінумабу у попередньо наповненому шприці. В дослідженні псоріазу 4 (JUNCTURE) оцінювали 182 пацієнтів, які застосовували секукінумаб у попередньо наповненій шприц-ручці порівняно з плацебо, через 12 тижнів після початку лікування для оцінки безпеки, переносимості та користі самостійного застосування секукінумабу у попередньо наповненій шприці-ручці. В обох дослідженнях (3 та 4) пацієнти були рандомізовані до групи секукінумабу в дозах 150 мг або 300 мг на 0, 1, 2 і 3 тижні з наступним щомісячним введенням аналогічної дози, починаючи з 4-го тижня. Пацієнти були також рандомізовані до групи плацебо на 0, 1, 2 і 3 тижні з наступним щомісячним введенням аналогічної дози, починаючи з 4-го тижня.
В дослідженні псоріазу 5 (SCULPTURE) оцінювали 966 пацієнтів. Всі пацієнти отримували секукінумаб в дозах 150 мг або 300 мг на 0, 1, 2, 3, 4, 8 та 12 тижні та потім були рандомізовані до групи щомісячного введення підтримуючої дози, починаючи з 12-го тижня, або до групи лікування у разі потреби в тій самій дозі. Пацієнти, рандомізовані до режиму лікування у разі потреби, не досягли задовільної відповіді на терапевтичне лікування, а отже, рекомендується щомісячна підтримуюча терапія фіксованими дозами.
Первинними складовими кінцевих точок в плацебо-контрольованих дослідженнях і дослідженнях з активним контролем були відсотки пацієнтів, які досягли PASI 75 і значень ІGA mod 2011 «чисто» або «майже чисто» порівняно з плацебо на 12-му тижні (див. таблиці 1 і 2). Доза 300 мг збільшує шкірний кліренс практично до значень «чисто» або «майже чисто» в кінцевих точках ефективності PASI 90, PASI 100 та IGA mod 2011 відповідно до індексу 0 або 1 у всіх дослідженнях з досягненням піка на 16-му тижні, отже, ця доза є рекомендованою.
Таблиця 1 Короткий огляд PASI 50/75/90/100 та IGA? mod 2011 «чисто» або «майже чисто» клінічної відповіді в рамках досліджень 1, 3 та 4 псоріазу (ERASURE, FEATURE та JUNCTURE)
Показники
Тиждень 12
Тиждень 16
Тиждень 52
плацебо
секукінумаб
секукінумаб
секукінумаб
150 мг
300 мг
150 мг
300 мг
150 мг
300 мг
Дослідження 1
Кількість пацієнтів
246
244
245
244
245
244
245
Відповідь PASI 50, n (%)
22 (8,9 %)
203
(83,5 %)
222
(90,6 %)
212
(87,2 %)
224
(91,4 %)
187
(77 %)
207
(84,5 %)
Відповідь PASI 75, n (%)
11 (4,5 %)
174
(71,6%)**
200
(81,6 %)**
188
(77,4 %)
211
(86,1 %)
146
(60,1 %)
182
(74,3 %)
Відповідь PASI 90, n (%)
3 (1,2 %)
95 (39,1%)**
145
(59,2 %)**
130
(53,5 %)
171
(69,8 %)
88
(36,2 %)
147
(60,0 %)
Відповідь PASI 100, n (%)
2 (0,8 %)
31
(12,8 %)
70
(28,6 %)
51
(21,0 %)
102
(41,6 %)
49
(20,2 %)
96
(39,2 %)
Відповідь IGA mod 2011 «чисто» або «майже чисто», n (%)
6 (2,40 %)
125
(51,2%)**
160
(65,3 %)**
142
(58,2 %)
180
(73,5 %)
101
(41,4 %)
148
(60,4 %)
Дослідження 3
Кількість пацієнтів
59
59
58
?
?
?
?
Відповідь PASI 50, n (%)
3 (5,1 %)
51 (86,4%)
51
(87,9 %)
?
?
?
?
Відповідь PASI 75, n (%)
0 (0,0 %)
41 (69,5%)**
44
(75,9 %)**
?
?
?
?
Відповідь PASI 90, n (%)
0 (0,0 %)
27
(45,8 %)
35
(60,3 %)
?
?
?
?
Відповідь PASI 100,
n (%)
0 (0,0 %)
5
(8,5 %)
25
(43,1 %)
?
?
?
?
Відповідь IGA mod 2011 «чисто» або «майже чисто», n (%)
0 (0,0 %)
31 (52,5%)**
40
(69,0 %)**
?
?
?
?
Дослідження 4
Кількість пацієнтів
61
60
60
?
?
?
?
Відповідь PASI 50, n (%)
5 (8,2 %)
48
(80,0 %)
58
(96,7 %)
?
?
?
?
Відповідь PASI 75, n (%)
2 (3,3 %)
43
(71,7%)**
52
(86,7 %)**
?
?
?
?
Відповідь PASI 90, n (%)
0 (0,0 %)
24
(40,0 %)
33
(55,0 %)
?
?
?
?
Відповідь PASI 100,
n (%)
0 (0,0 %)
10
(16,7 %)
16
(26,7 %)
?
?
?
?
Відповідь IGA mod 2011 «чисто» або «майже чисто», n (%)
0 (0,0 %)
32 (53,3%)**
44
(73,3 %)**
?
?
?
?
*IGA mod 2011 – це 5-бальна шкала, включаючи індекси 0 – «чисто», 1 – «майже чисто», 2 – «легкий ступінь», 3 – «помірний ступінь» або 4 – «тяжкий ступінь», що свідчить про загальну лікарську оцінку тяжкості псоріазу з огляду на затвердіння, еритему і лущення шкіри. Ефект лікування, який визначається як «чисто» або «майже чисто», полягає у відсутності ознак псоріазу або уражень природного або рожевого кольору, відсутності потовщення бляшок, а також у відсутності або мінімальному місцевому лущенні шкіри.
**Значення р проти плацебо і скориговані з урахуванням кратності: p < 0,0001.
Таблиця 2 Короткий огляд клінічної відповіді в рамках дослідження 2 псоріазу (FIXTURE)
Показники
Тиждень 12
Тиждень 16
Тиждень 52
плацебо
секукінумаб
етанер-цепт
секукінумаб
етанерцепт
секукінумаб
етанер-цепт
150 мг
300 мг
150 мг
300 мг
150 мг
300 мг
Кількість пацієнтів
324
327
323
323
327
323
323
327
323
323
Відповідь PASI 50, n (%)
49
(15,1 %)
266
(81,3 %)
296
(91,6 %)
226
(70,0 %)
290 (88,7 %)
302 (93,5 %)
257
(79,6 %)
249
(76,1 %)
274 (84,8 %)
234
(72,4 %)
Відповідь PASI 75, n (%)
16
(4,9 %)
219
(67,0%)**
249
(77,1%)**
142
(44,0 %)
247 (75,5 %)
280 (86,7 %)
189
(58,5 %)
215 (65,7 %)
254 (78,6 %)
179
(55,4 %)
Відповідь PASI 90, n (%)
5
(1,5 %)
137
(41,9 %)
175
(54,2 %)
67
(20,7 %)
176 (53,8 %)
234 (72,4 %)
101
(31,3 %)
147 (45,0 %)
210 (65,0 %)
108
(33,4 %)
Відповідь PASI 100, n (%)
0 (0 %)
47
(14,4 %)
78
(24,1 %)
14
(4,3 %)
84
(25,7 %)
119 (36,8 %)
24
(7,4 %)
65
(19,9 %)
117 (36,2 %)
32
(9,9 %)
Відповідь IGA mod 2011 «чисто» або «майже чисто», n (%)
9
(2,8 %)
167 (51,1%)**
202
(62,5%)**
88
(27,2 %)
200 (61,2 %)
244 (75,5 %)
127
(39,3 %)
168 (51,4 %)
219 (67,8 %)
120
(37,2 %)
**p значення проти етанерцепту: p = 0,0250.
У додатковому дослідженні псоріазу (CLEAR) оцінювали 676 пацієнтів. Секукінумаб в дозі 300 мг відповідав первинній та вторинній кінцевим точкам, демонструючи більшу ефективність, ніж устекінумаб, на підставі відповіді PASI 90 на 16-му тижні (первинна кінцева точка), швидкості початку відповіді PASI 75 на 4-му тижні та тривалої відповіді PASI 90 на 52-му тижні. Більш висока ефективність у порівнянні з устекінумабом для кінцевих точок PASI 75/90/100 та IGA mod 2011 відповідно до індексу 0 або 1 («чисто» або «майже чисто») спостерігалася на початку та продовжувалася до 52-го тижня.
Таблиця 3 Короткий огляд клінічної відповіді в рамках дослідження CLEAR
Показники
Тиждень 4
Тиждень 16
Тиждень 52
Секукінумаб 300 мг
Устекінумаб*
Секукінумаб 300 мг
Устекінумаб*
Секукінумаб 300 мг
Устекінумаб*
Кількість пацієнтів
334
335
334
335
334
335
Відповідь PASI 75, n (%)
166
(49,7 %)**
69
(20,6 %)
311
(93,1 %)
276
(82,4 %)
306
(91,6 %)
262
(78,2 %)
Відповідь PASI 90, n (%)
70
(21,0 %)
18
(5,4 %)
264
(79,0 %)**
192
(57,3 %)
250
(74,9 %)***
203
(60,6 %)
Відповідь PASI 100, n (%)
14
(4,2 %)
3
(0,9 %)
148
(44,3 %)
95
(28,4 %)
150
(44,9 %)
123
(36,7 %)
Відповідь IGA mod 2011 «чисто» або «майже чисто», n (%)
128
(38,3 %)
41
(12,2 %)
278
(83,2 %)
226
(67,5 %)
261
(78,1 %)
213
(63,6 %)
*Пацієнти, які отримували секукінумаб, приймали дозу 300 мг на 0, 1, 2, 3 тижні з наступним щомісячним введенням аналогічної дози, починаючи з 4 тижня до 52 тижня. Пацієнти, які отримували устекінумаб, приймали 45 мг або 90 мг на 0 та 4-ому тижні, потім кожні 12 тижнів до 52 тижня (дозування з урахуванням маси тіла відповідно до схваленої дози).
**p значення проти устекінумабу: p < 0,0001 для первинної кінцевої точки PASI 90 на 16-ому тижні та вторинної кінцевої точки PASI 75 на 4-ому тижні.
***p значення проти устекінумабу: p = 0,0001 для вторинної кінцевої точки PASI 90 на 52-ому тижні.
Секукінумаб продемонстрував ефективність у пацієнтів, які раніше не отримували системну терапію та терапію біологічними препаратами, у пацієнтів, які отримували терапію біологічними препаратами/анти-ФНП, а також у пацієнтів з недостатньою відповіддю на терапію біологічними препаратами/анти-ФНП. Покращення індексу PASI 75 у пацієнтів із супутнім псоріатичним артритом на початку дослідження аналогічне такому у загальній популяції пацієнтів із бляшковим псоріазом.
Прийом секукінумабу в дозі 300 мг був пов’язаний зі швидким початком прояву ефективності зі зниженням середнього показника PASI на 50 % на 3 тижні.
Тижні лікування
- кількість оцінюваних пацієнтів
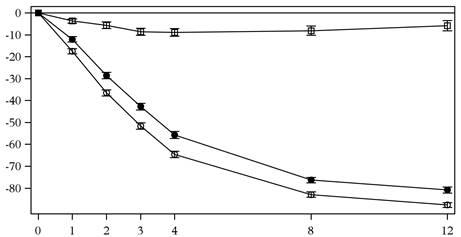
секукінумаб 150 мг (n = 243) секукінумаб 300 мг (n = 245) плацебо (n = 245)
Рис. 1. Зміни з плином часу у % від вихідного рівня середнього значення індексу PASI під час дослідження 1 (ERASURE).
Специфічна локалізація/ форми бляшкового псоріазу
Під час двох додаткових плацебо-контрольованих досліджень спостерігалося зменшення симптомів псоріазу нігтів (TRANSFIGURE, 198 пацієнтів) та долонно-підошовного бляшкового псоріазу (GESTURE, 205 пацієнтів). Під час дослідження TRANSFIGURE секукінумаб був більш ефективним, ніж плацебо, на 16-ому тижні (46,1 % в групі прийому 300 мг, 38,4 % в групі прийому 150 мг та 11,7 % в групі прийому плацебо) з точки зору значущого покращення відносно вихідних показників відповідно до індексу тяжкості псоріатичного ураження нігтів (NAPSI %) у пацієнтів з помірним або тяжким бляшковим псоріазом з ураженням нігтів. Під час дослідження GESTURE секукінумаб був більш ефективним, ніж плацебо, на 16-ому тижні (33,3 % в групі прийому 300 мг, 22,1 % в групі прийому 150 мг та 1,5 % в групі прийому плацебо) з точки зору значущого покращення ppIGA значень 0 або 1 («чисто» або «майже чисто») у пацієнтів з помірним або тяжким долонно-підошовним бляшковим псоріазом.
Під час плацебо-контрольованого дослідження оцінювали 102 пацієнтів з помірним або тяжким псоріазом шкіри голови з індексом тяжкості псоріазу шкіри голови (PSSI) ≥ 12, індексом IGA mod 2011 шкіри голови 3 або більше та щонайменше 30 % загальної площі ураженої шкіри голови. Секукінумаб в дозі 300 мг був більш ефективним, ніж плацебо, на 12-ому тижні з точки зору значущого покращення відносно вихідних показників відповідно до показника PSSI 90 (52,9 % проти 2,0 %) та показника IGA mod 2011 0 або 1 шкіри голови (56,9 % проти 5,9 %). Покращення за кожною кінцевою точкою зберігалися у пацієнтів, які продовжили приймати секукінумаб до 24-го тижня.
Якість життя/ результати, відмічені пацієнтами
Статистично значущі покращення на 12-ому тижні (дослідження 1–4) відносно вихідних показників порівняно з плацебо були продемонстровані відповідно до DLQI (дерматологічний індекс якості життя). Середні зниження (покращення) відповідно до DLQI відносно вихідних показників варіювали від ?10,4 до ?11,6 у пацієнтів, які приймали секукінумаб в дозі 300 мг, від ?7,7 до ?10,1 у пацієнтів, які приймали секукінумаб в дозі 150 мг, проти ?1,1 – ?1,9 у пацієнтів, які приймали плацебо на 12-ому тижні. Такі покращення зберігались протягом 52 тижнів (дослідження 1 та 2).
Сорок відсотків учасників досліджень 1 та 2 заповнили Щоденник Симптомів Псоріазу©. Учасники, які заповнювали щоденник в кожному з цих досліджень, показали статистично значущі покращення на 12-ому тижні відносно вихідних показників порівняно з плацебо щодо ознак та симптомів свербежу, болю та лущення шкіри.
Статистично значущі покращення на 4-ому тижні відносно вихідних показників у пацієнтів, які отримували секукінумаб, порівняно з пацієнтами, які отримували устекінумаб (CLEAR), були продемонстровані в DLQI, та ці покращення зберігалися протягом 52 тижнів.
Статистично значущі покращення у пацієнтів, у яких відмічались ознаки та симптоми свербежу, болю та лущення шкіри голови на 16 та 52 тижні (CLEAR), були продемонстровані у Щоденнику Симптомів Псоріазу© у пацієнтів, які отримували секукінумаб, порівняно з пацієнтами, які отримували устекінумаб.
У дослідженні псоріазу шкіри голови були продемонстровані статистично значущі покращення (зменшення) на 12-ому тижні відносно вихідних показників у пацієнтів, у яких відмічались ознаки та симптоми свербежу, болю та лущення шкіри голови, порівняно з плацебо.
Псоріатичний артрит
Під час трьох рандомізованих, подвійно сліпих, плацебо?контрольованих досліджень ІІІ фази за участю пацієнтів з активним псоріатичним артритом (≥ 3 набряклих суглобів та ≥ 3 болючих суглобів), незважаючи на терапію нестероїдними протизапальними препаратами (НПЗП), кортикостероїдами або хворобомодифікуючими антиревматичними препаратами, безпеку та ефективність секукінумабу оцінювали у 1999 пацієнтів. У ці дослідження були включені пацієнти з кожним підтипом псоріатичного артриту, включаючи поліартикулярний артрит без ревматоїдних вузликів, спондиліт з периферичним артритом, асиметричний периферичний артрит, ураження дистальних міжфалангових суглобів та мутилюючий артрит. Під час досліджень пацієнти мали в анамнезі псоріатичний артрит протягом щонайменше п’яти років. У більшості пацієнтів також був діагностований активний псоріаз з ураженням шкіри або документально підтверджений псоріаз в анамнезі. Понад 61 % та 42 % пацієнтів із псоріатичним артритом на початку дослідження мали ентезит та дактиліт відповідно. Для всіх досліджень первинною кінцевою точкою була відповідь за критеріями ACR (Американської колегії ревматології) 20. Щодо дослідження псоріатичного артриту 1 та дослідження псоріатичного артриту 2 первинна кінцева точка була досягнута на 24-ому тижні. Щодо дослідження псоріатичного артриту 3 первинна кінцева точка була досягнута на 16-ому тижні разом з основною вторинною кінцевою точкою, зміною відносно вихідних показників за модифікованою шкалою Шарпа (mTSS) на 24-ому тижні.
В дослідженні псоріатичного артриту 1, дослідженні псоріатичного артриту 2 та дослідженні псоріатичного артриту 3 29 %, 35 % та 30 % пацієнтів раніше отримували терапію анти?ФНПα засобом та припинили прийом анти-ФНПα засобу через відсутність ефективності або переносимості (пацієнти з недостатньою відповіддю на терапію анти-ФНПα).
В дослідженні псоріатичного артриту 1 (FUTURE 1) оцінювали 606 пацієнтів, з яких 60,7 % одночасно отримували метотрексат. Пацієнти, рандомізовані до групи секукінумабу, отримували 10 мг/кг внутрішньовенно на 0, 2 та 4-ому тижні, потім 75 мг або 150 мг підшкірно щомісяця, починаючи з 8 тижня. Пацієнти, рандомізовані до групи плацебо, які не відповіли на лікування на 16-ому тижні (препарат невідкладної допомоги), та інші пацієнти в групі плацебо на 24-ому тижні були переведені на секукінумаб (в дозі 75 мг або 150 мг підшкірно) з наступним щомісячним введенням аналогічної дози.
В дослідженні псоріатичного артриту 2 (FUTURE 2) оцінювали 397 пацієнтів, з яких 46,6 % одночасно отримували метотрексат. Пацієнти, рандомізовані до групи секукінумабу, отримували 75 мг, 150 мг або 300 мг підшкірно на 0, 1, 2, 3 тижні з наступним щомісячним введенням аналогічної дози, починаючи з 4 тижня. Пацієнти, рандомізовані до групи плацебо, які не відповіли на лікування на 16-ому тижні (рання відповідь), були переведені на секукінумаб (в дозі 150 мг або 300 мг підшкірно) на 16-ому тижні з наступним щомісячним введенням аналогічної дози. Пацієнти, рандомізовані до групи плацебо, які відповіли на лікування на 16-ому тижні, були переведені на секукінумаб (в дозі 150 мг або 300 мг підшкірно) на 24-ому тижні з наступним щомісячним введенням аналогічної дози.
В дослідженні псоріатичного артриту 3 (FUTURE 5) оцінювали 996 пацієнтів, з яких 50,1 % одночасно отримували метотрексат. Пацієнти були рандомізовані в групу секукінумабу в дозі 150 мг, 300 мг або плацебо підшкірно на 0, 1, 2, 3 тижні з наступним щомісячним введенням аналогічної дози, починаючи з 4 тижня, або щомісячної ін’єкції секукінумабу в дозі 150 мг (без навантаження). Пацієнти, рандомізовані до групи плацебо, які не відповіли на лікування на 16-ому тижні (рання відповідь), були переведені на секукінумаб (в дозі 150 мг або 300 мг підшкірно) на 16-ому тижні з наступним щомісячним введенням аналогічної дози. Пацієнти, рандомізовані до групи плацебо, які відповіли на лікування на 16-ому тижні, були переведені на секукінумаб (в дозі 150 мг або 300 мг підшкірно) на 24-ому тижні з наступним щомісячним введенням аналогічної дози.
Ознаки та симптоми
Лікування секукінумабом призвело до значного покращення показників активності захворювання у порівнянні з плацебо на 16 та 24-ому тижні (див. таблицю 4).
Таблиця 4 Клінічна відповідь у дослідженні псоріатичного артриту 2 та дослідженні псоріатичного артриту 3 на 16-мі та 24-му тижні
Показники
Дослідження псоріатичного артриту 2
Дослідження псоріатичного артриту 3
Плацебо
150 мг1
300 мг1
Плацебо
150 мг1
300 мг1
Кількість рандомізованих пацієнтів
98
100
100
332
220
222
Відповідь ACR 20, n (%)
Тиждень 16
18
(18,4 %)
60
(60,0%***)
57
(57,0%***)
91◊
(27,4 %)
122◊
(55,5%***)
139◊
(62,6 %***)
Тиждень 24
15◊
(15,3 %)
51◊
(51,0%***)
54◊
(54,0%***)
78
(23,5 %)
117
(53,2%***)
141
(63,5 %***)
Відповідь ACR 50, n (%)
Тиждень 16
6
(6,1 %)
37
(37,0%***)
35
(35,0%***)
27
(8,1 %)
79
(35,9 %*)
88
(39,6 %*)
Тиждень 24
7
(7,1 %)
35
(35,0 %)
35
(35,0 %**)
29
(8,7 %)
86
(39,1%***)
97
(43,7 %***)
Відповідь ACR 70, n (%)
Тиждень 16
2
(2,0 %)
17
(17,0 %**)
15
(15,0 %**)
14
(4,2 %)
40
(18,2%***)
45
(20,3 %***)
Тиждень 24
1
(1,0 %)
21
(21,0 %**)
20
(20,0 %**)
13
(3,9 %)
53
(24,1%***)
57
(25,7 %***)
DAS28?CRP
Тиждень 16
- 0,50
- 1,45***
- 1,51***
- 0,63
- 1,29*
- 1,49*
Тиждень 24
- 0,96
- 1,58**
- 1,61**
- 0,84
- 1,57***
- 1,68***
Кількість пацієнтів з ≥ 3 % псоріазом шкіри від ППТ на вихідному рівні
43
(43,9 %)
58
(58,0 %)
41
(41,0 %)
162
(48,8 %)
125
(56,8 %)
110
(49,5 %)
Відповідь PASI 75, n (%)
Тиждень 16
3
(7,0 %)
33
(56,9%***)
27
(65,9%***)
20
(12,3 %)
75
(60,0 %*)
77
(70,0 %*)
Тиждень 24
7
(16,3 %)
28
(48,3 %**)
26
(63,4%***)
29
(17,9 %)
80
(64,0%***)
78
(70,9 %***)
Відповідь PASI 90, n (%)
Тиждень 16
3
(7,0 %)
22
(37,9%***)
18
(43,9%***)
15
(9,3 %)
46
(36,8 %*)
59
(53,6 %*)
Тиждень 24
4
(9,3 %)
19
(32,8 %**)
20
(48,8%***)
19
(11,7 %)
51
(40,8%***)
60
(54,5 %***)
Розвиток дактилітів, n (%) †
Тиждень 16
10
(37 %)
21
(65,6 %*)
26
(56,5 %)
40
(32,3 %)
46
(57,5 %*)
54
(65,9 %*)
Тиждень 24
4
(14,8 %)
16
(50,0 %**)
26
(56,5 %**)
42
(33,9 %)
51
(63,8%***)
52
(63,4 %***)
Усунення ентезитів, n (%) ‡
Тиждень 16
17
(26,2 %)
32
(50,0 %**)
32
(57,1%***)
68
(35,4 %)
77
(54,6 %*)
78
(55,7 %*)
Тиждень 24
14
(21,5 %)
27
(42,2 %*)
27
(48,2 %**)
66
(34,4 %)
77
(54,6%***)
86
(61,4 %***)
*p < 0,05, **p < 0,01, ***p < 0,001 проти плацебо.
Всі p-значення коригуються з урахуванням кратності випробувань на підставі попередньо визначеної ієрархії на 24-ому тижні щодо дослідження псоріатичного артриту 2, за винятком ACR 70, дактиліту та ентезиту, які були пошуковими кінцевими точками та всіма кінцевими точками на 16-ому тижні.
Всі p-значення коригуються з урахуванням кратності випробувань на підставі попередньо визначеної ієрархії на 16-ому тижні щодо дослідження псоріатичного артриту 3, за винятком ACR 70, який був пошуковою кінцевою точкою та всіма кінцевими точками на 24-ому тижні.
Для відсутньої бінарної кінцевої точки використовується метод підстановки даних при відсутності відповіді.
ACR – Американська колегія ревматології; PASI – індекс площі та тяжкості псоріазу; DAS – індекс активності захворювання; ППТ – площа поверхні тіла.
◊Первинна кінцева точка.
1 Секукінумаб 150 мг або 300 мг підшкірно на 0, 1, 2, 3 тижні з наступним щомісячним введенням аналогічної дози, починаючи з 4 тижня.
†У пацієнтів з дактилітом на початку дослідження (n=27, 32, 46, відповідно щодо дослідження псоріатичного артриту 2 та n=124, 80, 82, відповідно щодо дослідження псоріатичного артриту 3).
‡У пацієнтів з ентезитом на початку дослідження (n=65, 64, 56, відповідно щодо дослідження псоріатичного артриту 2 та n=192, 141, 140, відповідно щодо дослідження псоріатичного артриту 3).
Початок дії секукінумабу спостерігається вже на 2 тижні. Статистично значуща різниця ACR 20 між групою секукінумабу і плацебо досягається на 3 тижні.
Кількість пацієнтів, які досягли відповіді ACR 20 відповідно до візиту, показана на рис. 2.
Час (тижні)
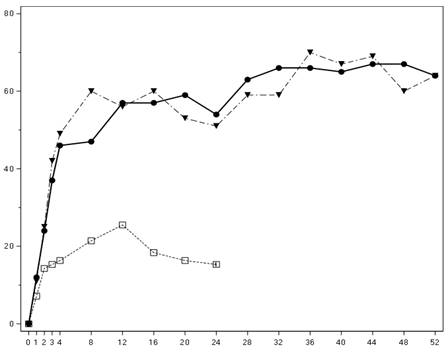
плацебо
секукінумаб, 300 мг
секукінумаб, 150 мг
Рис. 2. Відповідь ACR 20 в рамках дослідження псоріатичного артриту 2 з плином часу до 52 тижня.
Аналогічні відповіді щодо первинних та основних вторинних кінцевих точок спостерігались у пацієнтів із псоріатичним артритом незалежно від одночасного застосування метотрексату. В дослідженні псоріатичного артриту 2 на 24-му тижні у пацієнтів в групі комбінованого застосування секукінумабу і метотрексату зареєстрована більш висока відповідь ACR 20 (47,7 % та 54,4 % пацієнтів в групі прийому дози 150 мг та 300 мг порівняно з 20,0 % в групі плацебо) та відповідь ACR 50 (31,8 % та 38,6 % пацієнтів в групі прийому дози 150 мг та 300 мг порівняно з 8,0 % в групі плацебо). У пацієнтів в групі секукінумабу без одночасного застосування метотрексату зареєстрована більш висока відповідь ACR 20 (53,6 % та 53,6 % пацієнтів у групі прийому дози 150 мг та 300 мг порівняно з 10,4 % в групі плацебо) та відповідь ACR 50 (37,5 % та 32,1 % пацієнтів у групі прийому дози 150 мг та 300 мг порівняно з 6,3 % в групі плацебо).
В дослідженні псоріатичного артриту 2 як у пацієнтів, які не отримували терапію анти?ФНПα, так і у пацієнтів з недостатньою відповіддю на терапію анти?ФНПα, які приймали секукінумаб, відзначалась більш висока відповідь ACR 20 порівняно з плацебо на 24-му тижні, при цьому дещо вища відповідь спостерігалась в групі пацієнтів, які не отримували терапію анти?ФНПα (пацієнти, які не отримували терапію анти?ФНПα: 64 % та 58 % – в групі прийому дози 150 мг та 300 мг порівняно з 15,9 % в групі плацебо; пацієнти з недостатньою відповіддю на терапію анти?ФНПα: 30 % та 46 % в групі прийому дози 150 мг та 300 мг порівняно з 14,3 % в групі плацебо). В підгрупі пацієнтів з недостатньою відповіддю на терапію анти?ФНПα тільки прийом дози 300 мг продемонстрував значно вищу частоту відповіді ACR 20 порівняно з плацебо (p < 0,05), а також клінічно значущі переваги, ніж прийом дози 150 мг, щодо декількох вторинних кінцевих точок. Покращення за індексом PASI 75 спостерігались в обох підгрупах, а прийом дози 300 мг показав статистично значущі переваги у пацієнтів з недостатньою відповіддю на терапію анти?ФНПα.
Покращення спостерігались за усіма показниками шкали ACR, включаючи оцінку болю пацієнтами. Під час дослідження псоріатичного артриту 2 кількість пацієнтів, які досягли відповіді за модифікованими критеріями відповіді псоріатичного артриту (PsARC), була вищою в групі секукінумабу (59,0 % та 61,0 % в групі прийому дози 150 мг та 300 мг), ніж в групі плацебо (26,5 %), на 24-му тижні.
В дослідженні псоріатичного артриту 1 та дослідженні псоріатичного артриту 2 ефективність зберігалась до 104-го тижня. В дослідженні псоріатичного артриту 2 серед 200 пацієнтів, які спочатку були рандомізовані до групи секукінумабу в дозі 150 мг та 300 мг, 178 (89 %) все ще отримували лікування на 52-му тижні. Зі 100 пацієнтів, рандомізованих до групи секукінумабу в дозі 150 мг, 64, 39 та 20 осіб досягли відповіді ACR 20/50/70 відповідно. Зі 100 пацієнтів, рандомізованих до групи секукінумабу в дозі 300 мг, 64, 44 та 24 особи досягли відповіді ACR 20/50/70 відповідно.
Рентгенологічна відповідь
У дослідженні псоріатичного артриту 3 пригнічення прогресування структурного ураження оцінювалось рентгенографічно та визначалось за модифікованою шкалою Шарпа (mTSS) та її компонентами, показником ерозій та звуження суглобової щілини. Рентгенологічні знімки рук, зап’ястків та ніг були зроблені на початку дослідження, на 16-му тижні та/або 24-му тижні та оцінювались незалежно щонайменше двома фахівцями, яким не було надано інформації про групи лікування та номер візиту. Секукінумаб в дозі 150 мг та 300 мг значно пригнічував швидкість прогресування ураження периферичного суглоба порівняно з плацебо, розраховану як зміна відносно вихідних показників за mTSS на 24-му тижні (таблиця 5).
Пригнічення прогресування структурного ураження також оцінювалось під час дослідження псоріатичного артриту 1 на 24-му та 52-му тижні відносно вихідних показників. Дані на 24-тижні представлено в таблиці 5.
Таблиця 5 Зміни показника модифікованої шкали Шарпа при псоріатичному артриті
Показники
Дослідження псоріатичного артриту 3
Дослідження псоріатичного артриту 1
плацебо
n = 296
Секукінумаб
150 мг1
n = 213
Секукінумаб
300 мг1
n = 217
плацебо
n = 179
секукінумаб
150 мг2
N = 185
Загальна кількість балів
Вихідний рівень
(SD)
15,0
(38,2)
13,5
(25,6)
12,9
(23,8)
28,4
(63,5)
22,3
(48,0)
Середня зміна на 24-ому тижні
0,50
0,13*
0,02*
0,57
0,13*
*p < 0,05 на підставі номінального, але не скоригованого p-значення.
1Секукінумаб в дозі 150 мг або 300 мг підшкірно на 0, 1, 2, 3 тижні з наступним щомісячним введенням аналогічної дози, починаючи з 4 тижня.
210 мг/кг на 0, 2 тижні з наступним введенням підшкірної дози 75 мг або 150 мг, починаючи з 4 тижня.
В дослідженні псоріатичного артриту 1 пригнічення структурного ураження зберігалось до 52-го тижня при прийомі секукінумабу.
В дослідженні псоріатичного артриту 3 кількість пацієнтів з відсутністю прогресування захворювання (визначено, як зміна відносно вихідних показників за шкалою mTSS ≤ 0,5) від початку рандомізації до 24-го тижня становила 80,3 %, 88,5 % та 73,6 % в групі прийому секукінумабу в дозі 150 мг, 300 мг та плацебо. Вплив пригнічення структурного ураження спостерігався у пацієнтів, які не отримували терапію анти?ФНПα, та пацієнтів з недостатньою відповіддю на терапію анти?ФНПα, а також у пацієнтів, які одночасно приймали або не приймали метотрексат.
В дослідженні псоріатичного артриту 1 кількість пацієнтів з відсутністю прогресування захворювання (визначено, як зміна відносно вихідних показників за шкалою mTSS ≤ 0,5) від початку рандомізації до 24-го тижня становила 82,3 % в групі прийому секукінумабу в дозі 10 мг/кг внутрішньовенно – 150 мг підшкірно як підтримуючої дози та 75,7 % в групі плацебо. Кількість пацієнтів з відсутністю прогресування з 24-го тижня по 52-й тиждень в групі внутрішньовенного введення секукінумабу в дозі 10 мг/кг з наступним введенням дози 150 мг підшкірно як підтримуючої дози та в групі плацебо, які були переведені на дозу 75 мг або 150 мг підшкірно кожні 4 тижні на 16-ому тижні або 24-ому тижні, становила 85,7 % та 86,8 %.
Аксіальні прояви у пацієнтів із псоріатичним артритом (PsA)
У рандомізованому, подвійно сліпому, плацебо-контрольованому дослідженні (MAXIMIZE) оцінювали ефективність секукінумабу у 485 пацієнтів із псоріатичним артритом з аксіальними проявами, які не отримували лікування біологічними препаратами та неадекватно реагували на НПЗП. Була виконана первинна змінна, що показала покращення щонайменше на 20 % за критеріями оцінки Міжнародного товариства спондилоартриту (ASAS 20) на 12 тижні. Лікування секукінумабом у дозі 300 мг та 150 мг у порівнянні з плацебо також призвело до більш значного полегшення ознак та симптомів (включаючи зменшення болю у хребті від початкового рівня) та покращення фізичних функцій (див. таблицю 6).
Таблиця 6
Клінічна відповідь у дослідженні MAXIMISE на 12 тижні
Показники
Плацебо
(n = 164)
150 мг
(n = 157)
300 мг
(n = 164)
Відповідь ASAS 20, %
(95 % CI)
31,2 (24,6, 38,7)
66,3 (58,4, 73,3)*
62,9 (55,2, 70,0)*
Відповідь ASAS 40, %
(95 % CI)
12,2 (7,8, 18,4)
39,5 (32,1, 47,4)**
43,6 (36,2, 51,3)**
BASDAI 50, %
(95 % CI)
9,8 (5,9, 15,6)
32,7 (25,8, 40,5)**
37,4 (30,1, 45,4)**
Спінальний біль, VAS
(95 % CI)
- 13,6 (-17,2, -10,0)
- 28,5 (-32,2, -24,8)**
- 26,5 (-30,1, -22,9)**
Фізичні функції,
HAQ DI
(95 % CI)
- 0,155 (-0,224, -0,086)
- 0,330 (-0,401, -0,259)**
- 0,389 (-0,458, -0,320)**
* p < 0,0001; порівняно з плацебо з використанням множинної імпутації.
** Порівняння з плацебо не було скориговано на множинність.
ASAS – оцінка критеріїв Міжнародного товариства спондилоартриту; BASDAI – Батський індекс активності анкілозуючого спондиліту; VAS – візуальна аналогова шкала; HAQ DI – опитувальник для оцінки стану здоров’я – індекс працездатності.
Покращення показників ASAS 20 і ASAS 40 при застосуванні обох доз секукінумабу спостерігалося на 4 тижні і зберігалося до 52 тижнів.
Якість життя, пов’язана з функціональним статусом і станом здоров’я
Під час дослідження псоріатичного артриту 2 та дослідження псоріатичного артриту 3 пацієнти, які отримували секукінумаб в дозі 150 мг (p = 0,0555 та p < 0,0001) та 300 мг (p = 0,0040 та p < 0,0001), продемонстрували покращення функціонального статусу порівняно з пацієнтами, які отримували плацебо, відповідно до індексу порушення життєдіяльності, підрахованого за опитувальником для оцінки стану здоров’я (HAQ?DI), на 24-му та 16-му тижнях. Покращення показників відповідно до HAQ?DI спостерігалось, незважаючи на попередню терапію анти?ФНПα. Аналогічні відповіді відмічені в дослідженні псоріатичного артриту 1.
Пацієнти, які приймали секукінумаб, відмічали значуще покращення пов’язаної зі станом здоров’я якості життя, розраховане за скороченою формою шкали неспецифічного опитувальника для оцінки фізичного компонента здоров’я (SF?36 PCS) (p < 0,001). Також спостерігалось статистично значуще покращення щодо пошукових кінцевих точок за шкалою функціональної оцінки терапії хронічного захворювання–втоми (FACIT-F) при прийомі 150 мг та 300 мг порівняно з плацебо (7,97, 5,97 проти 1,63). В дослідженні псоріатичного артриту 2 ці покращення зберігались до 104-го тижня.
Подібні відповіді були відмічені в дослідженні псоріатичного артриту 1, а ефективність зберігалася до 52-го тижня.
Аксіальний спондилоартрит
Анкілозуючий спондиліт (AC)/ рентгенологічний аксіальний спондилоартрит
Під час двох рандомізованих, подвійно сліпих, плацебо?контрольованих досліджень III фази за участю пацієнтів з активним анкілозуючим спондилітом з показниками відповідно до Батського індексу активності анкілозуючого спондиліту (BASDAI) ≥ 4, незважаючи на терапію нестероїдними протизапальними препаратами (НПЗП), кортикостероїдами або хворобомодифікуючими антиревматичними препаратами, безпеку та ефективність секукінумабу оцінювали у 816 пацієнтів. В ході дослідження анкілозуючого спондиліту 1 та дослідження анкілозуючого спондиліту 2 пацієнтам був діагностований анкілозуючий спондиліт з медіаною тривалості 2,7–5,8 року. В обох цих дослідженнях первинною кінцевою точкою було щонайменше 20 % покращення за критеріями міжнародного товариства з вивчення спондилоартритів (ASAS 20) на 16-ому тижні.
В дослідженні анкілозуючого спондиліту 1, дослідженні анкілозуючого спондиліту 2 та дослідженні анкілозуючого спондиліту 3 27,0 %, 38,8 % та 23,5 % пацієнтів раніше отримували терапію анти?ФНПα засобом та припинили прийом анти-ФНПα засобу через відсутність ефективності або непереносимість (пацієнти з недостатньою відповіддю на терапію анти-ФНПα).
В дослідженні анкілозуючого спондиліту 1 (MEASURE 1) оцінювали 371 пацієнта, з яких 14,8 % та 33,4 % одночасно застосовували метотрексат або сульфасалазин. Пацієнти, рандомізовані до групи секукінумабу, отримували 10 мг/кг внутрішньовенно на 0, 2 та 4 тижні з наступним щомісячним введенням дози 75 мг або 150 мг підшкірно, починаючи з 8-го тижня. Пацієнти, рандомізовані до групи плацебо, не відповіли на лікування на 16-ому тижні (рання відповідь), всі інші пацієнти в групі плацебо на 24-му тижні були переведені на секукінумаб (в дозі 75 мг або 150 мг підшкірно) з наступним щомісячним введенням аналогічної дози.
В дослідженні анкілозуючого спондиліту 2 (MEASURE 2) оцінювали 219 пацієнтів, з яких 11,9 % та 14,2 % одночасно застосовували метотрексат або сульфасалазин. Пацієнти, рандомізовані до групи секукінумабу, отримували 75 мг або 150 мг підшкірно на 0, 1, 2, 3 тижні з наступним щомісячним введенням аналогічної дози, починаючи з 4 тижня. На 16-ому тижні пацієнти, які були рандомізовані до групи плацебо на початку дослідження, були повторно рандомізовані до групи секукінумабу (в дозі 75 мг або 150 мг підшкірно) при щомісячному режимі введення.
В дослідженні анкілозуючого спондиліту 3 (MEASURE 3) оцінювали 226 пацієнтів, з яких 13,3 % та 23,5 % одночасно застосовували метотрексат або сульфасалазин. Пацієнти, рандомізовані до групи секукінумабу, отримували 10 мг/кг внутрішньовенно на 0, 2 та 4 тижні з наступним введенням дози 150 мг або 300 мг підшкірно щомісяця. На 16-ому тижні пацієнти, які були рандомізовані до групи плацебо на початку дослідження, були повторно рандомізовані до групи секукінумабу (в дозі 150 мг або 300 мг підшкірно) зі щомісячним режимом введення. Первинною кінцевою точкою була відповідь ASAS 20 на 16-му тижні. Пацієнти отримували лікування у сліпому режимі до 52-го тижня. Дослідження продовжувалось до 156 тижня.
Ознаки та симптоми
У дослідженні анкілозуючого спондиліту 2 лікування секукінумабом в дозі 150 мг призводило до значного зменшення активності захворювання порівняно з плацебо на 16-ому тижні (див. таблицю 7).
Таблиця 7
Клінічна відповідь в рамках дослідження анкілозуючого спондиліту 2 на 16-ому тижні
Результат (p-значення проти плацебо)
Плацебо
(n = 74)
Секукінумаб
75 мг (n = 73)
150 мг (n = 72)
Відповідь ASAS 20, %
28,4
41,1
61,1***
Відповідь ASAS 40, %
10,8
26,0
36,1***
hsCRP, (пост?BSL/BSL співвідношення)
1,13
0,61
0,55***
ASAS 5/6, %
8,1
34,2
43,1***
Часткова ремісія ASAS, %
4,1
15,1
13,9
BASDAI 50, %
10,8
24,7*
30,6**
Значне покращення ASDAS-CRP
4,1
15,1*
25,0***
*p < 0,05, **p < 0,01, ***p < 0,001 проти плацебо.
Всі p-значення коригуються з урахуванням кратності випробувань на підставі попередньо визначеної ієрархії, окрім BASDAI 50 та ASDAS-CRP.
Для відсутньої бінарної кінцевої точки використовується метод підстановки даних при відсутності відповіді.
ASAS – критерії міжнародного товариства з вивчення спондилоартритів; BASDAI – Батський індекс активності анкілозуючого спондиліту; hsCRP – високочутливий С-реактивний протеїн; ASDAS – шкала активності анкілозуючого спондиліту; BSL – вихідний рівень.
Під час дослідження анкілозуючого спондиліту 2 початок дії секукінумабу в дозі 150 мг спостерігався вже на 1-му тижні щодо ASAS 20 та на 2-му тижні щодо ASAS 40 (більш ефективний, ніж плацебо).
При прийомі секукінумабу в дозі 150 мг порівняно з плацебо відповідь ASAS 20 була вищою: покращилась на 16-ому тижні і у пацієнтів, які не отримували терапію анти?ФНПα (68,2 % проти 31,1 %; p < 0,05), і у пацієнтів з недостатньою відповіддю на терапію анти?ФНПα (50,0 % проти 24,1 %; p < 0,05).
Під час кожного дослідження анкілозуючого спондиліту пацієнти, які приймали секукінумаб (150 мг в рамках дослідження анкілозуючого спондиліту 2 та обидва режими в рамках дослідження анкілозуючого спондиліту 1), продемонстрували значне зменшення ознак та симптомів на 16-ому тижні з порівнянною величиною відповіді та ефективністю, що зберігались до 52-го тижня, у пацієнтів, які не отримували терапію анти?ФНПα, та пацієнтів з недостатньою відповіддю на терапію анти?ФНПα. У дослідженні анкілозуючого спондиліту 2 із 72 пацієнтів, які спочатку були рандомізовані до групи секукінумабу в дозі 150 мг, 61 (84,7 %) все ще отримували лікування на 52-му тижні. З 72 пацієнтів, рандомізованих до групи секукінумабу в дозі 150 мг, у 45 та 35 пацієнтів зафіксована відповідь АСАС 20 та 40 відповідно.
Під час дослідження анкілозуючого спондиліту 3 у пацієнтів, які отримували секукінумаб (в дозі 150 мг та 300 мг), спостерігалось покращення ознак та симптомів і збереження ефективності, незважаючи на дозу, порівняно із плацебо на 16-му тижні щодо первинної кінцевої точки (ASAS 20). Загалом, частота збереження ефективності в групі прийому 300 мг була значно вищою, ніж в групі прийому 150 мг, щодо вторинних кінцевих точок. Під час сліпого періоду відповіді за критеріями ASAS 20 та ASAS 40 становили 69,7 % та 47,6 % відповідно у групі прийому 150 мг та 74,3 % і 57,4 % відповідно в групі прийому 300 мг на 52-му тижні. Відповіді ASAS 20 та ASAS 40 зберігались до 156-го тижня (69,5 % та 47,6 % відповідно в групі прийому 150 мг проти 74,8 % та 55,6 % відповідно в групі прийому 300 мг). Більша частота відповіді, що спостерігалась в групі застосування 300 мг, також відзначалась стосовно часткової ремісії (ASAS PR) на 16-му тижні та підтримувалась до 156-го тижня. Відмінності щодо більшої частоти відповідей, що спостерігались в групі застосування 300 мг, порівняно з групою 150 мг, відзначались у пацієнтів, які отримували анти-ФНПα терапію (n = 36), порівняно з пацієнтами, які не отримували анти-ФНПα терапію (n = 114).
Рухливість хребта
Пацієнти, які отримували секукінумаб в дозі 150 мг, продемонстрували покращення рухливості хребта, оціненої за зміною порівняно з вихідним рівнем індексу порушень рухів в хребті при АС (BASMI) на 16-ому тижні в рамках дослідження анкілозуючого спондиліту 1 (?0,40 проти ?0,12 в групі плацебо; p = 0,0114) та дослідження анкілозуючого спондиліту 2 (?0,51 проти ?0,22 в групі плацебо; p = 0,0533). Такі покращення зберігались до 52-го тижня.
Якість життя, пов’язана з функціональним статусом і станом здоров’я
Під час дослідження анкілозуючого спондиліту 1 та дослідження анкілозуючого спондиліту 2 пацієнти, які отримували секукінумаб в дозі 150 мг, продемонстрували покращення пов’язаної зі станом здоров’я якості життя, розраховане за шкалою опитувальника для оцінки якості життя при анкілозуючому спондиліті (ASQoL) (p=0,001) та шкалою SF-36 фізичного компонента здоров’я (SF-36PCS) (p<0.001). Пацієнти, які отримували секукінумаб в дозі 150 мг, також продемонстрували статистично значуще покращення щодо пошукових кінцевих точок функціонального статусу відповідно до Батського індексу функціональних порушень при анкілозуючому спондиліті (BASFI) порівняно з плацебо (?2,15 проти ?0,68), а також втоми за шкалою функціональної оцінки терапії хронічного захворювання–втоми (FACIT-втома) порівняно з плацебо (8,10 проти 3,30). Такі покращення зберігались до 52-го тижня.
Нерентгенологічний аксіальний спондилоартрит
Безпеку та ефективність секукінумабу оцінювали під час одного рандомізованого, подвійно сліпого, плацебо-контрольованого дослідження фази ІІІ (PREVENT), що складається з дворічної основної фази та дворічної розширеної фази, за участю 555 пацієнтів з активним нерентгенологічним аксіальним спондилоартритом, які відповідали критеріям класифікації Міжнародного товариства з дослідження спондилоартриту (ASAS), за відсутності рентгенологічних доказів зміни крижово-клубового суглоба, що відповідало Модифікованим нью-йоркським критеріям для діагностики анкілозуючого спондиліту (АС). У пацієнтів, які брали участь у дослідженні, встановлювалось захворювання в активній фазі зі значенням Індексу активності захворювання анкілозуючим спондилітом (BASDAI), що дорівнює ≥ 4, за візуальною аналоговою шкалою болю в спині на рівні ≥ 40 (в діапазоні 0 або 100 мм), незважаючи на поточну або попередню терапію нестероїдними протизапальними препаратами (НПЗП) та підвищений рівень високочутливого С-реактивного білка та/або докази розвитку сакроілітиту на МРТ. Пацієнтам в рамках цього дослідження діагностували аксіальний спондилоартрит протягом в середньому 2,1–3,0 року. 54 % учасників дослідження були жінками.
Під час дослідження PREVENT 9,7 % пацієнтів раніше отримували терапію анти-ФНПα засобом та припинили прийом анти-ФНПα засобу через відсутність ефективності або непереносимість (пацієнти з недос
 В вашей корзине
В вашей корзине
 вход в интернет магазин:
вход в интернет магазин: